NMPA I 關于發布實施牙膏備案資料管理規定的公告牙膏備案的紙質資料應當使用國際標準A4型規格紙張,內容完整清晰、不得涂改。牙膏的包裝展開圖片等確需更大尺寸紙張的,可使用其他規格紙張,確保妥善置于 A4 規格資料內。紙質文件資料的載體和書寫材料應當符合耐久性的要求。
為貫徹落實《牙膏監督管理辦法》,規范牙膏備案工作,國家藥監局制定了《牙膏備案資料管理規定》,現予發布,自2023年12月1日起施行。
不限 NMPA 廣東省 江蘇省 浙江省 上海市 北京市 安徽省 河北省 山西省 吉林省 遼寧省 黑龍江省 陜西省 甘肅省 青海省 山東省 福建省 臺灣省 河南省 湖北省 湖南省 江西省 海南省 四川省 貴州省 云南省 天津市 重慶市
不限 2024 2023 2022 2021 2020 2019 2018 2017 2016 2015 2014 2013 2012 2011 2010 2009 2008 2007 2006

為貫徹落實《牙膏監督管理辦法》,規范牙膏備案工作,國家藥監局制定了《牙膏備案資料管理規定》,現予發布,自2023年12月1日起施行。

根據國家藥品監督管理局2023年度醫療器械注冊審查指導原則制修訂計劃的有關要求,醫療器械技術審評中心組織編制了《血液透析設備注冊審查指導原則》《X射線平板探測成像設備注冊審查指導原則》《離心式血液成分分離設備注冊審查指導原則(2023年修訂版)》3項醫療器械注冊審查指導原則,現向社會公開征求意見。

該產品包含股骨髁假體、脛骨托假體、半月板假體。股骨髁假體和脛骨托假體由鈷鉻鉬粉材經激光增材制造而成,半月板假體由超高分子量聚乙烯材料制成。該產品采用全膝關節假體的個性化設計,其關節曲面仿生設計能夠重建正常股髕關節運動功能。

《實施細則》對第二類、第三類醫療器械批發、零售經營企業,第一類醫療器械經營者,以及醫療器械零售連鎖企業實施《醫療器械經營質量管理規范》的要求進行細化。各地要廣為宣傳,鼓勵和引導已持有《第三類醫療器械經營許可證》《第二類醫療器械經營備案憑證》的醫療器械經營企業符合《實施細則》要求。

(一)并聯審批、能聯盡聯
(二)多證聯辦、能合盡合
(三)流程再造、能快盡快
(四)簡政提效、能簡盡簡
(五)激活市場、能優盡優
(六)事中事后、加強監管

及《浙江省人民政府辦公廳關于“精準對接精準服務”支持醫療器械產業提升發展的若干意見》(浙政辦發〔2014〕141號)精神,我局制定了《浙江省醫療器械注冊申報人員培訓服務制度》,現予印發,請遵照執行。

2016年9月15日起向浙江省食品藥品監督管理局提交藥品及醫療器械產品注冊申請事項的注冊申請人,其注冊申請事項經浙江省食品藥品監督管理局形式審查符合本省藥品、醫療器械產品注冊受理條件的,應按照本省藥品、醫療器械產品注冊收費標準繳納注冊費。

省局制定了《浙江省食品藥品監督管理局醫療器械經營企業飛行檢查工作程序》,現印發給你們,請遵照執行。其中,飛行檢查報告錄入省局醫療器械GSP檢查信息數據庫的工作,待數據庫建成后開展。


已有808次查看

已有722次查看
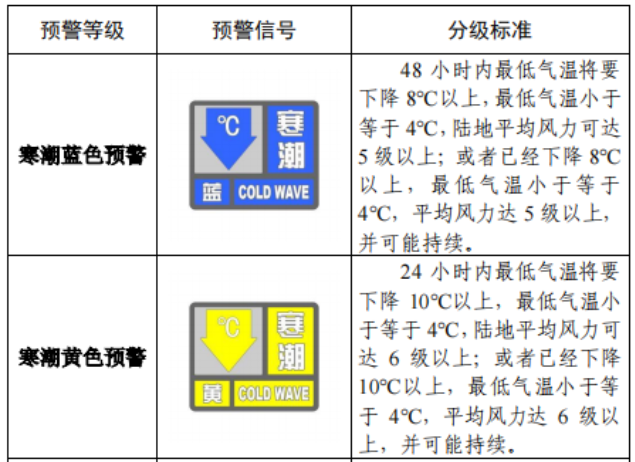
已有745次查看
已有723次查看

已有732次查看
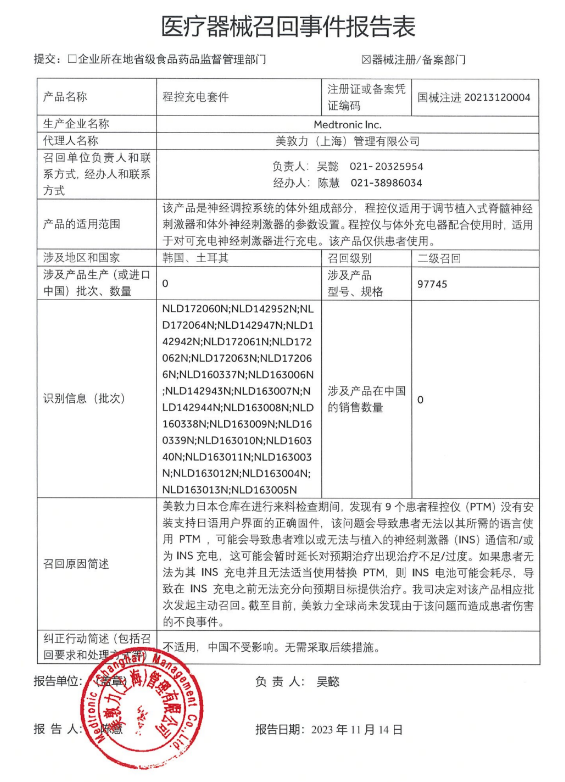
已有835次查看

已有737次查看
已有704次查看
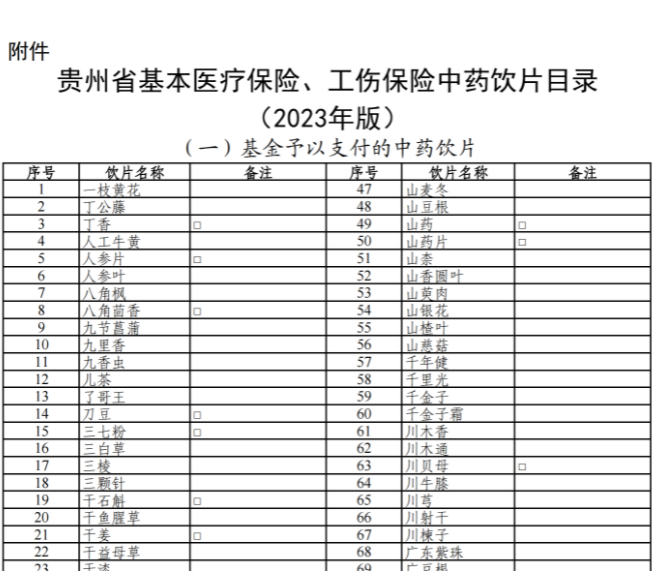
已有721次查看

已有704次查看





