醫(yī)療器械PMDA注冊究竟是什么?醫(yī)療器械PMDA注冊對產(chǎn)品的技術(shù)和質(zhì)量要求非常高,需要申請人具備完善的技術(shù)和質(zhì)量管理體系。
醫(yī)療器械PMDA注冊是指在日本厚生勞動省進行醫(yī)療器械上市前申請的過程。PMDA是日本厚生勞動省的英文縮寫,負責監(jiān)管日本的醫(yī)療器械市場,對醫(yī)療器械的上市前申請進行審批。
不限 動態(tài) 標準 智能 創(chuàng)新 技術(shù) 融資 cro 專利 實驗 區(qū)域 比賽 服務 報告 醫(yī)療 數(shù)據(jù) 高端 生態(tài) 學會 設(shè)備
不限 2024 2023 2022 2021 2020 2019 2018 2017 2016 2015 2014 2013 2012 2011 2010 2009 2008 2007 2006

醫(yī)療器械PMDA注冊是指在日本厚生勞動省進行醫(yī)療器械上市前申請的過程。PMDA是日本厚生勞動省的英文縮寫,負責監(jiān)管日本的醫(yī)療器械市場,對醫(yī)療器械的上市前申請進行審批。

醫(yī)療器械臨床CRO的首要職責是根據(jù)醫(yī)療器械的特點和目標,設(shè)計科學、嚴謹、可行的臨床試驗方案。試驗方案包括試驗目的、試驗設(shè)計、樣本量、觀察指標、數(shù)據(jù)分析方法等。

創(chuàng)新醫(yī)療器械注冊需要提交完整的注冊申請資料,包括產(chǎn)品技術(shù)文件、質(zhì)量管理體系文件、臨床試驗報告等。這些資料必須真實、準確、完整,才能夠通過監(jiān)管部門的審查。

在歐亞聯(lián)盟內(nèi)進行醫(yī)療器械注冊,企業(yè)需要向所在國家的監(jiān)管部門提交申請材料。這些材料包括醫(yī)療器械的技術(shù)文件、質(zhì)量管理體系文件、臨床試驗報告等。
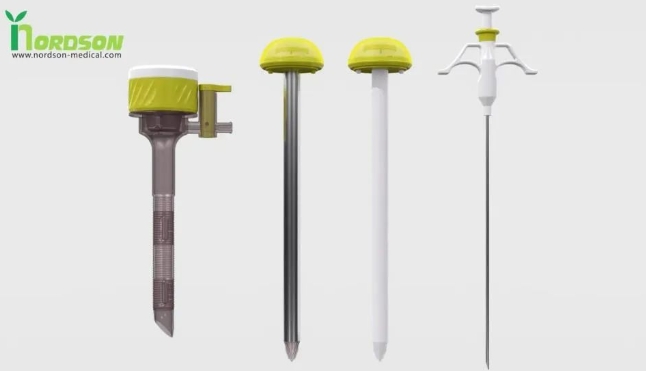
有一家叫NORDSON Medical (諾信醫(yī)學)的創(chuàng)新公司和一家叫XPAN(艾克斯畔)的創(chuàng)新公司在穿刺器的創(chuàng)新方面提供了兩種不同的新方向,其中Nordson medical創(chuàng)新地將臨床剛需的全分離式穿刺器+可視性的穿刺錐+為解決臨床筋膜縫合的痛點而誕生的筋膜閉合器做了一個非常巧妙的集成設(shè)計,解決了臨床中確切的痛點,進行了比較大的創(chuàng)新,發(fā)明了一款叫一次性套管穿刺器型筋膜閉合器。

外資企業(yè)在相當長的時間中幾乎壟斷了內(nèi)窺鏡市場,產(chǎn)品得到等級醫(yī)院的充分認可。不過,近年來國內(nèi)企業(yè)在內(nèi)窺鏡賽道持續(xù)發(fā)力,市場份額顯著提升。
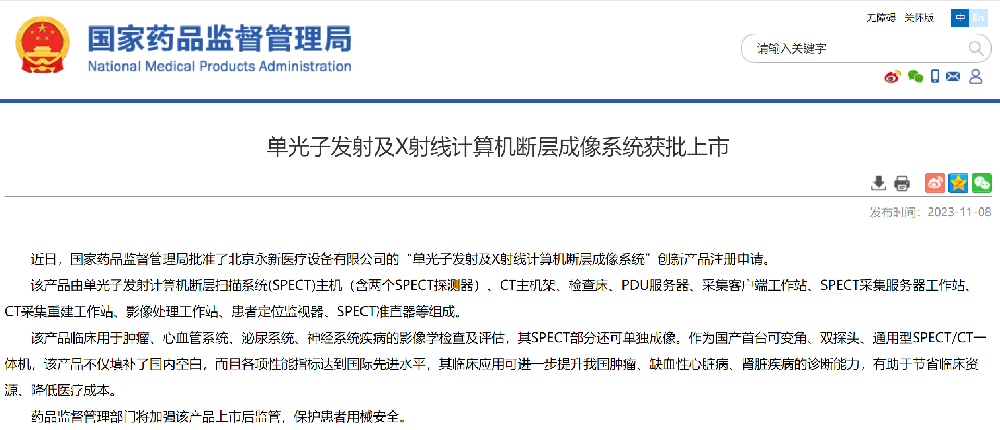
該產(chǎn)品由單光子發(fā)射計算機斷層掃描系統(tǒng)(SPECT)主機(含兩個SPECT探測器)、CT主機架、檢查床、PDU服務器、采集客戶端工作站、SPECT采集服務器工作站、CT采集重建工作站、影像處理工作站、患者定位監(jiān)視器、SPECT準直器等組成。

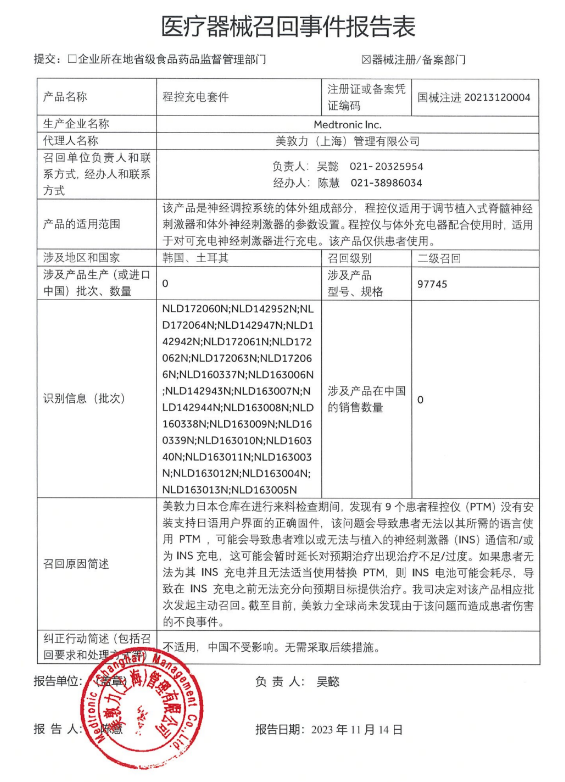
FDA批準的Paradise?系統(tǒng)預期用途聲明該系統(tǒng)適用于生活方式改變和藥物不足以控制血壓的患者。Paradise?系統(tǒng)使用超聲波能量來干擾來自交感神經(jīng)的信號,其治療機制與美敦力(Medtronic)使用射頻能量的Symplicity Spyral略有不同,Symplicity Spyral已經(jīng)于2013年獲得了CE。


已有833次查看

已有743次查看
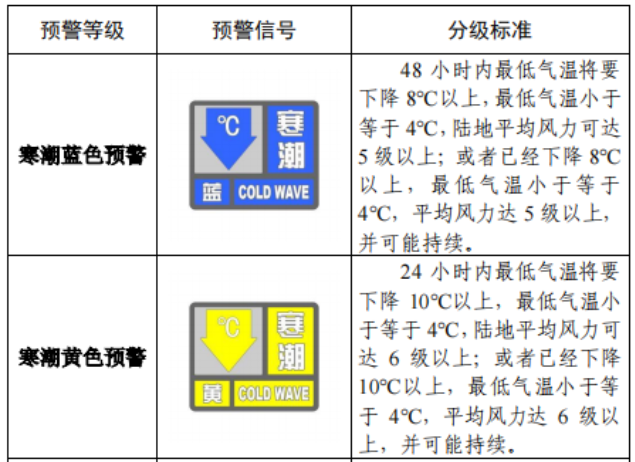
已有762次查看
已有742次查看

已有753次查看
已有854次查看

已有756次查看
已有723次查看
已有744次查看

已有718次查看





