醫療器械注冊法規主要有哪些?這些法規在醫療器械注冊和管理方面具有重要意義。通過這些法規的規范和引導,可以確保醫療器械的安全性和有效性得到保障,維護公眾的健康和安全。同時,這些法規也為企業提供了明確的注冊和管理指導,有助于提高企業的管理水平和產品質量。
醫療器械注冊法規是規范和管理醫療器械注冊申請、審批、監督和處罰等相關活動的法規文件。這些法規主要涉及醫療器械的分類、注冊程序、技術要求、監督管理等方面,以確保醫療器械的安全性和有效性。
不限 2024 2023 2022 2021 2020 2019 2018 2017 2016 2015 2014 2013 2012 2011 2010 2009 2008 2007 2006

醫療器械注冊法規是規范和管理醫療器械注冊申請、審批、監督和處罰等相關活動的法規文件。這些法規主要涉及醫療器械的分類、注冊程序、技術要求、監督管理等方面,以確保醫療器械的安全性和有效性。

作為一家新生代創新醫療器械企業,領博生物能夠成功完成大額融資,充分說明了資本市場對于其團隊以及所處細分賽道的高度認可與看好。此次A輪融資資金,將主要用于公司的生物型人工血管的注冊性臨床試驗,同時持續推進公司其他管線的研發和進一步完善公司技術成果轉化平臺的建設。

ResMed宣布了一種新的運營模式,以加速長期增長,向全球高管團隊介紹產品、收入和營銷方面的領導力。據介紹,重組高管層旨在強調ResMed對產品開發、盈利增長和強化品牌的重視通告。現在,加入執行領導團隊的是產品、收入和營銷官員,他們都是從內部提拔的,并且都已經生效。執行領導團隊已經包括了商業、財務、法律、人事和戰略主管。

“一帶一路”醫療器械創新與應用聯盟秘書長、上海理工大學醫療器械學院院長程云章介紹稱,平均來看,國外醫療器械產品的價格是我國同類產品的5至10倍,中亞地區可能成為我國醫療器械企業出海的重要市場。
據介紹,目前我國醫療器械出口中,出口到“一帶一路”共建國家的占比約三分之一,且以低值耗材為主,未來向創新產品轉變仍有較大的增長空間。

我們需要了解什么是三類醫療器械。根據國家食品藥品監督管理總局(CFDA)的規定,三類醫療器械是指具有較高風險,需要嚴格控制管理以保證其安全有效的醫療器械。例如植入式心臟起搏器、人工關節、血管支架等都屬于三類醫療器械。

醫療器械生產企業許可證申請表:該申請表需加蓋公章,并填寫企業相關信息,包括企業名稱、地址、生產地址、生產范圍等。
產品技術要求:產品技術要求是備案資料的核心,包括產品的主要技術指標、性能指標、安全性指標等,需按照國家相關法規和標準進行編制。

在開始產品注冊之前,企業需要了解國家相關法規和政策,包括《醫療器械監督管理條例》、《醫療器械注冊管理辦法》、《醫療器械生產監督管理辦法》等。這些法規和政策明確了醫療器械產品注冊的流程和要求,為產品注冊提供了指導。

在申請三類醫療器械生產許可證變更之前,企業需要了解相關的法規和政策。這些法規和政策包括《醫療器械監督管理條例》、《醫療器械注冊管理辦法》、《醫療器械生產監督管理辦法》等。企業需要仔細閱讀這些法規和政策,并確保在變更申請過程中遵守相關規定。


已有833次查看

已有743次查看
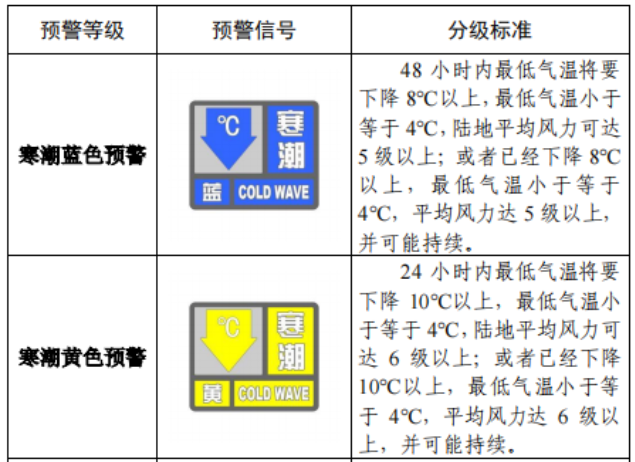
已有762次查看
已有742次查看

已有753次查看
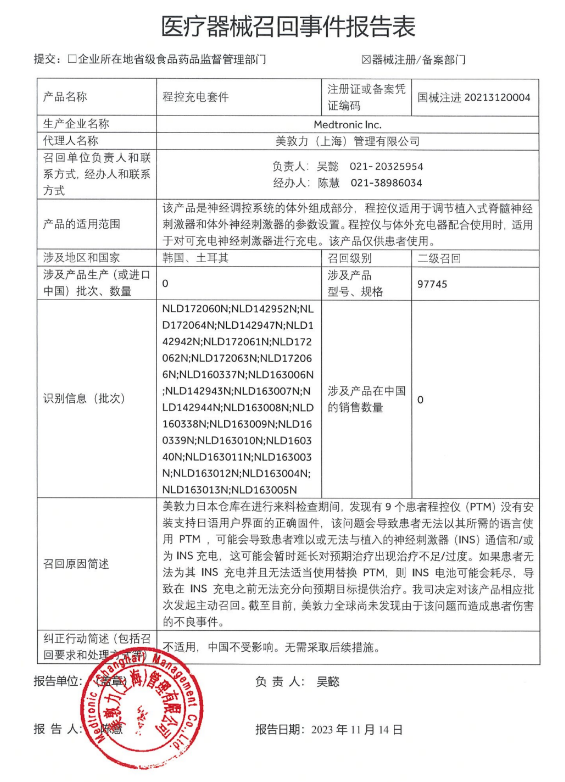
已有854次查看

已有756次查看
已有723次查看
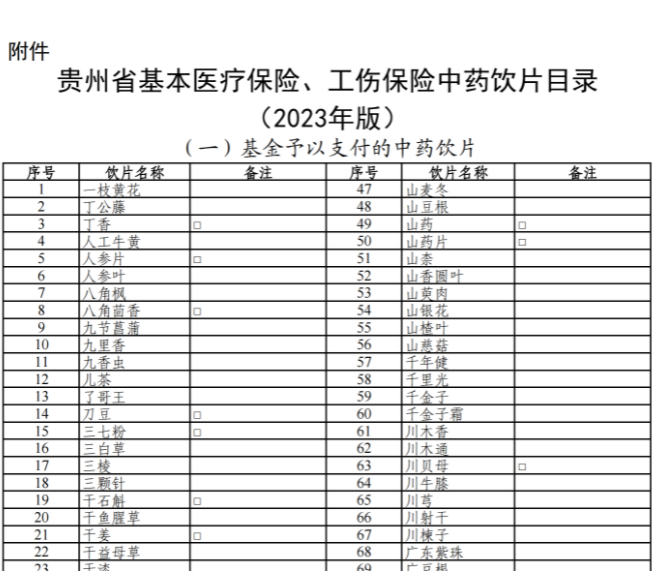
已有744次查看

已有718次查看





