中國制造商一定要關注FDA的8個注冊重點新型器械可以通過申請De Novo確定產(chǎn)品風險等級,如被分為Ⅰ類或Ⅱ類器械需要參考510(k)遞交申請,對于Ⅲ類高風險器械則需進行PMA申請。
美國食品藥品監(jiān)督管理局(FDA)負責監(jiān)管和批準醫(yī)療器械,確保其安全性和有效性。同時中國制造商為了在美國市場順利地銷售其器械,注冊是制造商必須完成的一項程序。
不限 動態(tài) 標準 智能 創(chuàng)新 技術 融資 cro 專利 實驗 區(qū)域 比賽 服務 報告 醫(yī)療 數(shù)據(jù) 高端 生態(tài) 學會 設備
不限 2024 2023 2022 2021 2020 2019 2018 2017 2016 2015 2014 2013 2012 2011 2010 2009 2008 2007 2006

美國食品藥品監(jiān)督管理局(FDA)負責監(jiān)管和批準醫(yī)療器械,確保其安全性和有效性。同時中國制造商為了在美國市場順利地銷售其器械,注冊是制造商必須完成的一項程序。
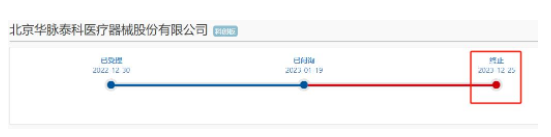
又一家采用科創(chuàng)板第五套上市標準的IPO項目宣布終止。12月25日,上交所發(fā)布公告表示,因北京華脈泰科醫(yī)療器械股份有限公司(簡稱“華脈泰科”)及其保薦人撤回發(fā)行上市申請,終止其發(fā)行上市審核。華脈泰科于2022年底上市申請獲受理,3月底回復首輪問詢,此后審核就處于停滯狀態(tài),直到如今撤回。
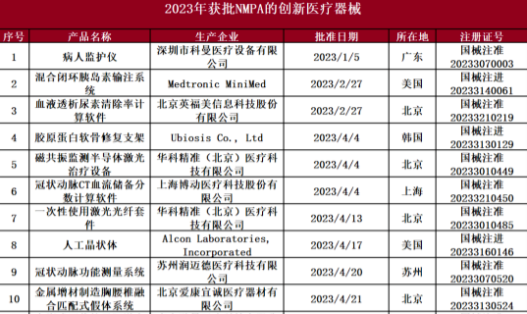
2023年獲批的56款創(chuàng)新醫(yī)療器械中,包含了16款心血管相關器械,3款眼科器械,8款影像類器械,10款手術機器人器械,4款骨科植入類器械,以及15款其他創(chuàng)新醫(yī)療器械

一如預期所料,美國國際貿(mào)易委員會(the U.S. International Trade Commission,ITC)禁止進口和銷售使用了血氧水平讀取技術(Technology for Reading Blood-Oxygen Levels)的Apple Watch的決定于本周二(2023年12月26日)正式生效。此前,美國拜登政府沒有推翻ITC的決定。
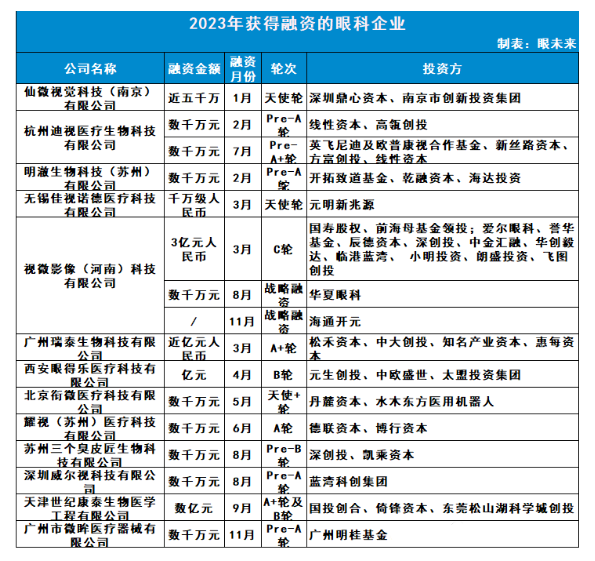
在我國,眼科疾病患者人數(shù)規(guī)模龐大,對眼科診療的需求屬于藍海。而大部分眼科疾病都依賴于眼科器械治療。眼科器械主要包括眼科設備和高值眼科耗材。目前,全球前十名眼科器械公司均為外資企業(yè),共占據(jù)97.9%的市場份額,國產(chǎn)眼科器械替代潛力巨大。

2023年春季發(fā)表的一項研究曾表明,助聽器可能有助于降低癡呆癥風險,但由于研究作者發(fā)現(xiàn)研究中出現(xiàn)編碼錯誤而最終撤回相關研究。該研究于2023年4月13日發(fā)表在The Lancet Public Health(柳葉刀公共衛(wèi)生)上(原文地址:https://doi.org/10.1016/S2468-2667(23)00048-8),該期刊已于12月12日撤回該文章。

近期,該雜志評選出了2023年最佳發(fā)明(THE BEST INVENTIONS OF 2023),包含200項突破性發(fā)明(以及50項特別提及發(fā)明),這些發(fā)明覆蓋人工智能、消費電子產(chǎn)品、設計、醫(yī)療保健等22個領域,其中有10款醫(yī)療器械獲得最佳發(fā)明。

經(jīng)過多年的發(fā)展沉淀,海思卡爾形成了以完整血管介入為主導,腔內介入醫(yī)療器械為重點發(fā)展方向的業(yè)務布局,并匯集多名國際一流的光、聲、電能量控制技術研發(fā)、醫(yī)用復合材料與涂層等工藝開發(fā)和國內權威的臨床及科研機構專家,搭建臨床應用、工程理論、技術轉化的多溝通橋梁,快速推進微創(chuàng)介入器械的開發(fā)與臨床轉化,管線覆蓋微創(chuàng)通路、介入診斷、精準治療領域。


已有833次查看

已有743次查看
已有762次查看
已有742次查看

已有753次查看
已有854次查看

已有756次查看
已有723次查看
已有744次查看

已有718次查看





