印度尼西亞市場的注冊流程和準入要求
不限 2024 2023 2022 2021 2020 2019 2018 2017 2016 2015 2014 2013 2012 2011 2010 2009 2008 2007 2006




在醫療器械領域國產品牌與國外企業的市場爭奪戰中,中國民族醫企無畏艱難,成功走出了本土品牌的獨特發展道路。以邁瑞為代表的本土企業擔綱民族品牌崛起之重任,躬身入局微創外科領域的超聲刀市場,并取得成果,逐步改變國內的市場格局。

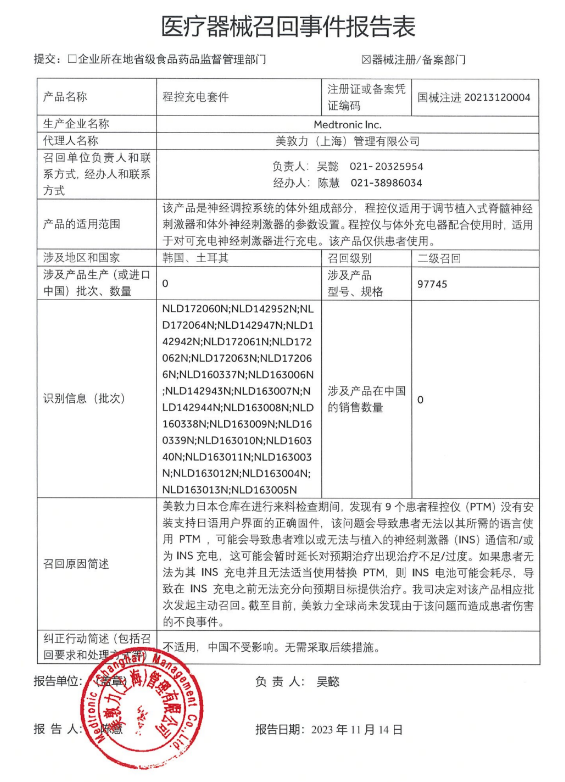
主動召回在醫療器械企業里其實很常見,但到一級召回的不多。一級召回指的是使用的醫療器械可能或已經引起嚴重健康危害,是最嚴重的召回級別。

質子治療作為精準放射治療領域的藍海地帶,在國內的治療可及性卻不高。以“攻克質子卡脖子技術,實現尖端醫療設備國產化”為目標,由瑞金醫院與中國科學院上海應用物理研究所、中國科學院上海高等研究院、上海艾普強粒子設備有限公司聯合研發的國產首臺質子治療系統(SAPT-PS-01),2022-6-3已完成上市前臨床試驗,全部受試者的3個月隨訪結果證明,腫瘤局控率達到100%,前列腺癌患者無生化復發率達100%。未發生3級及以上急性毒性反應。
基于良好的治療療效及安全性數據,國產首臺質子治療系統已于2022-9-26正式獲得《中華人民共和國醫療器械注冊證》。
境外生產商首先需要指定印度境內的代理持證人,角色包含總代、注冊代理等,直接與CDSCO溝通注冊等事宜。代理持證公司具體收費(代持證書費用、進口業務費用等)自定。代理持證人必須持有有效的批發許可證(表格20B和21B / 21C)。

在飛利浦向FDA提交了270份醫療器械報告(Medical Device Reporting,MDR)后,FDA發布了一份安全通訊(原文地址:https://www.fda.gov/medical-devices/safety-communications/carefully-monitor-philips-dreamstation-2-cpap-machines-signs-overheating-fda-safety-communication),警告消費者注意CPAP機器過熱的跡象。這些報告投訴DreamStation 2 CPAP機器存在發熱問題,其中部分報告還詳細說明了患者受傷(例如燒傷)的情況。這270份MDR文件的收集時間從2023年8月1日至2023年11月15日,相比之下,過去三年飛利浦偉康收到的有關該型號器械的MDR還不足30份。


已有843次查看

已有748次查看
已有768次查看
已有750次查看

已有758次查看
已有862次查看

已有763次查看
已有729次查看
已有750次查看

已有726次查看





