醫療器械產品注冊的思路流程詳細說明醫療器械產品注冊是確保醫療器械安全有效的重要環節。本文將詳細闡述醫療器械產品注冊的思路流程,包括前期準備、申請材料準備、審核與批準等環節。
在開始產品注冊之前,企業需要了解國家相關法規和政策,包括《醫療器械監督管理條例》、《醫療器械注冊管理辦法》、《醫療器械生產監督管理辦法》等。這些法規和政策明確了醫療器械產品注冊的流程和要求,為產品注冊提供了指導。
不限 2024 2023 2022 2021 2020 2019 2018 2017 2016 2015 2014 2013 2012 2011 2010 2009 2008 2007 2006

在開始產品注冊之前,企業需要了解國家相關法規和政策,包括《醫療器械監督管理條例》、《醫療器械注冊管理辦法》、《醫療器械生產監督管理辦法》等。這些法規和政策明確了醫療器械產品注冊的流程和要求,為產品注冊提供了指導。

在申請三類醫療器械生產許可證變更之前,企業需要了解相關的法規和政策。這些法規和政策包括《醫療器械監督管理條例》、《醫療器械注冊管理辦法》、《醫療器械生產監督管理辦法》等。企業需要仔細閱讀這些法規和政策,并確保在變更申請過程中遵守相關規定。

申請二類醫療器械注冊的第一步是取得營業執照。營業執照是企業的法定證明文件,它證明了企業的合法性和經營能力。申請人在申請二類醫療器械注冊前,必須先取得營業執照,并確保營業執照上的經營范圍包括醫療器械的制造或銷售。

此次在進博會首發的“AiBLE數智骨科/神外創新生態”,有機整合了美敦力的內植入物和手術機器人、手術導航系統、手術動力系統等智能設備,以及外部合作伙伴產品與技術,協同增益,引領行業邁入全病程管理的數智化時代,共同打造開放共贏的數智創新生態圈。

歐陽黎明對省計量院和可孚醫療科技股份有限公司在院企深度合作、產學研一體化等方面取得的工作成效給予肯定。他指出,要推進“走基層、找問題、想辦法、促發展”活動走深走實,聚焦醫療器械產業關鍵共性技術瓶頸和測試難題,加強醫療器械產業計量測試技術、方法和設備的研究和應用,強化計量在產品研發、設計、試驗、生產和使用等全過程的保障作用

醫療器械流通企業位于醫療器械行業上游生產和下游銷售之間,連接醫療器械生產廠商、各級醫療機構以及患者。也在一定程度上降低了生產廠商的銷售成本,同時根據醫療機構實際需求科學管理庫存,儲存部分產品,有利于維持醫療器械供銷穩定。
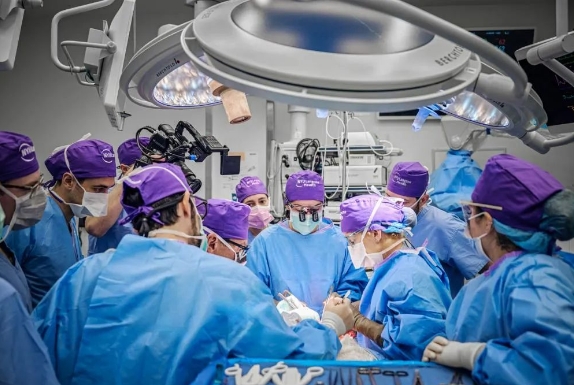
這項人類史上的首次全眼移植發生在今年5月,在眼部手術與部分面部移植手術同時進行的六個月時間里,這名46歲的患者的眼部已經顯示出良好的健康跡象。

該產品基于患者顱骨缺損的影像學數據,創新性采用聚醚醚酮醫用粉料,經選擇性激光燒結增材制造加工而成,能夠匹配患者缺損部位,通過三維嵌入方式實現顱骨缺損替代,恢復患者原顱骨曲率實現缺損區三維重建。


已有809次查看

已有723次查看
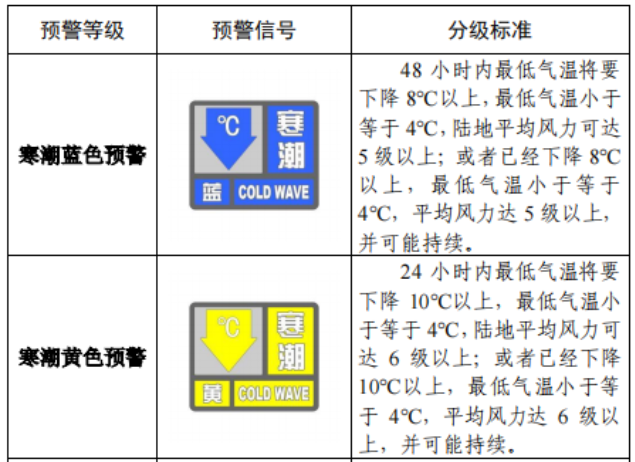
已有746次查看
已有724次查看

已有733次查看
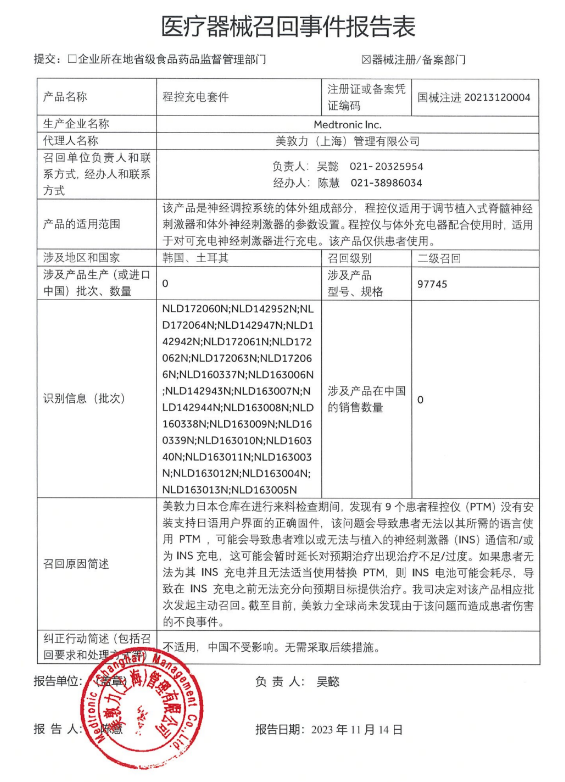
已有836次查看

已有737次查看
已有705次查看
已有722次查看

已有705次查看





