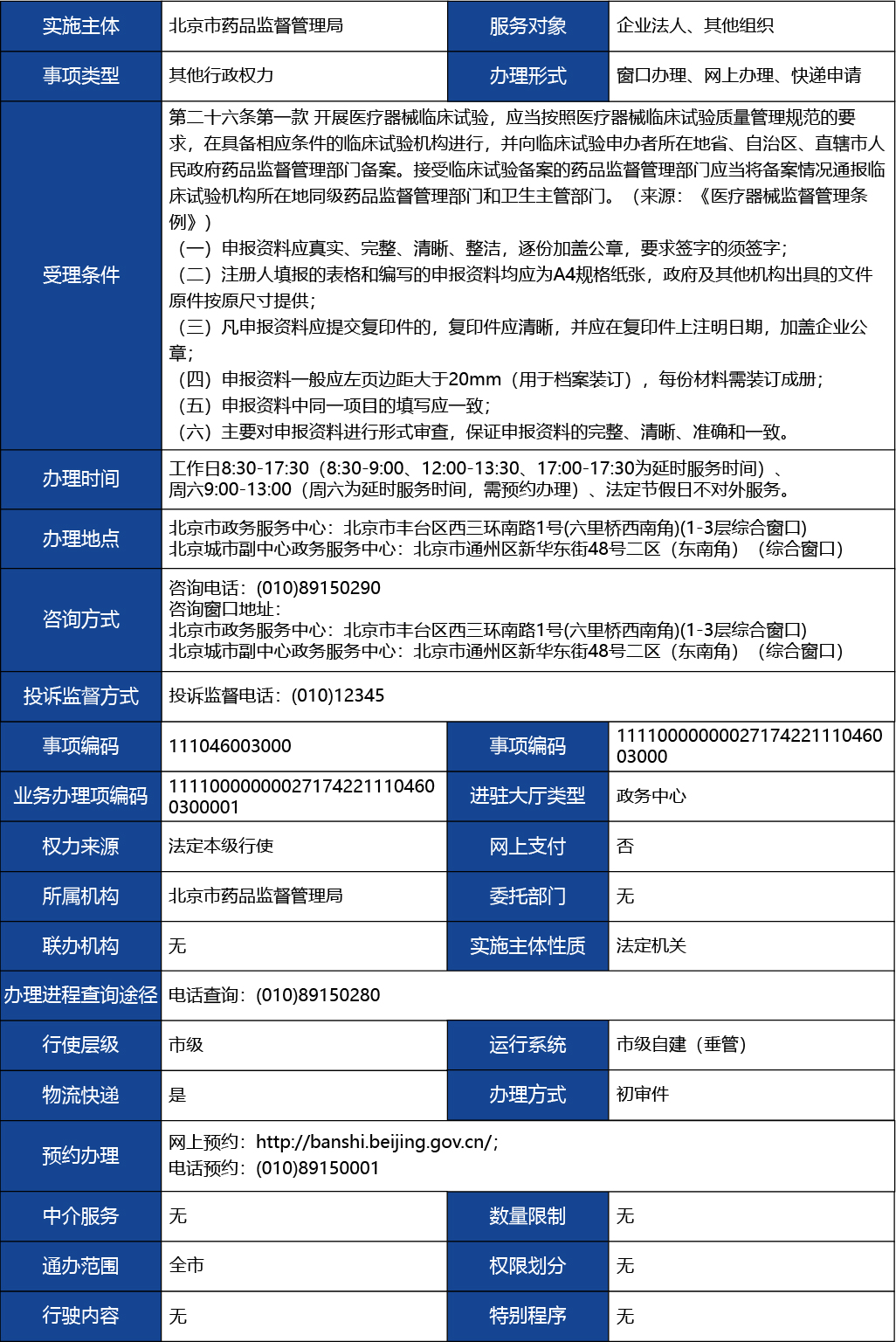
第二十六條第一款 開展醫療器械臨床試驗,應當按照醫療器械臨床試驗質量管理規范的要求,在具備相應條件的臨床試驗機構進行,并向臨床試驗申辦者所在地省、自治區、直轄市人民政府藥品監督管理部門備案。接受臨床試驗備案的藥品監督管理部門應當將備案情況通報臨床試驗機構所在地同級藥品監督管理部門和衛生主管部門。(來源:《醫療器械監督管理條例》)
(一)申報資料應真實、完整、清晰、整潔,逐份加蓋公章,要求簽字的須簽字;
(二)注冊人填報的表格和編寫的申報資料均應為A4規格紙張,政府及其他機構出具的文件原件按原尺寸提供;
(三)凡申報資料應提交復印件的,復印件應清晰,并應在復印件上注明日期,加蓋企業公章;
(四)申報資料一般應左頁邊距大于20mm(用于檔案裝訂),每份材料需裝訂成冊;
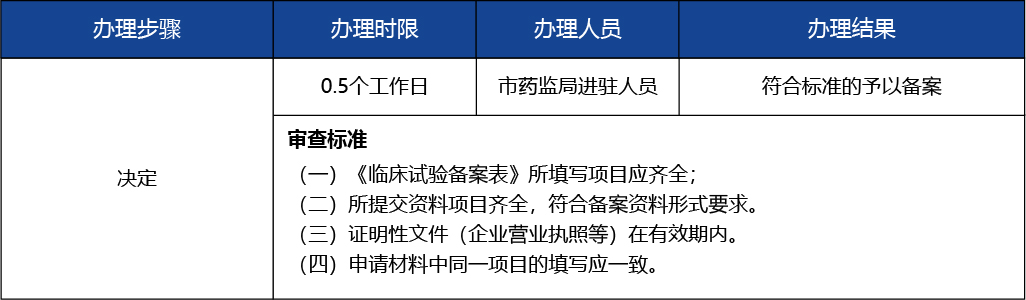
(五)申報資料中同一項目的填寫應一致;
(六)主要對申報資料進行形式審查,保證申報資料的完整、清晰、準確和一致。
申請與受理1
審查與決定2
-
頒證與送達3




是否收費:否
| 1、什么時間開始實施的臨床試驗項目需要進行備案? |
|---|
| 根據國家食品藥品監督管理總局《關于醫療器械臨床試驗備案有關事宜的公告》(2015年第87號)的要求,2015年7月3日之后開始實施的臨床試驗項目需要進行備案。其中,2015年7月3日前已在承擔臨床試驗項目的部分臨床試驗機構開始實施的臨床試驗項目,進行備案時除應將全部臨床試驗機構予以備案外,還應提交關于該項目在各個臨床試驗機構實施的時間說明。 |
| 2、同一臨床試驗方案能否在2個臨床試驗機構實施,是否為多中心? |
|---|
| 根據《醫療器械臨床試驗質量管理規范》(國家藥監局 國家衛生健康委關于發布《醫療器械臨床試驗質量管理規范》的公告2022年第28號)第五十四條規定:多中心臨床試驗是指按照同一臨床試驗方案,在兩個以上(含兩個)醫療器械臨床試驗機構實施的臨床試驗。申辦者實施多中心醫療器械臨床試驗應當符合《醫療器械臨床試驗質量管理規范》第五十五條和第五十六條的規定。 |





