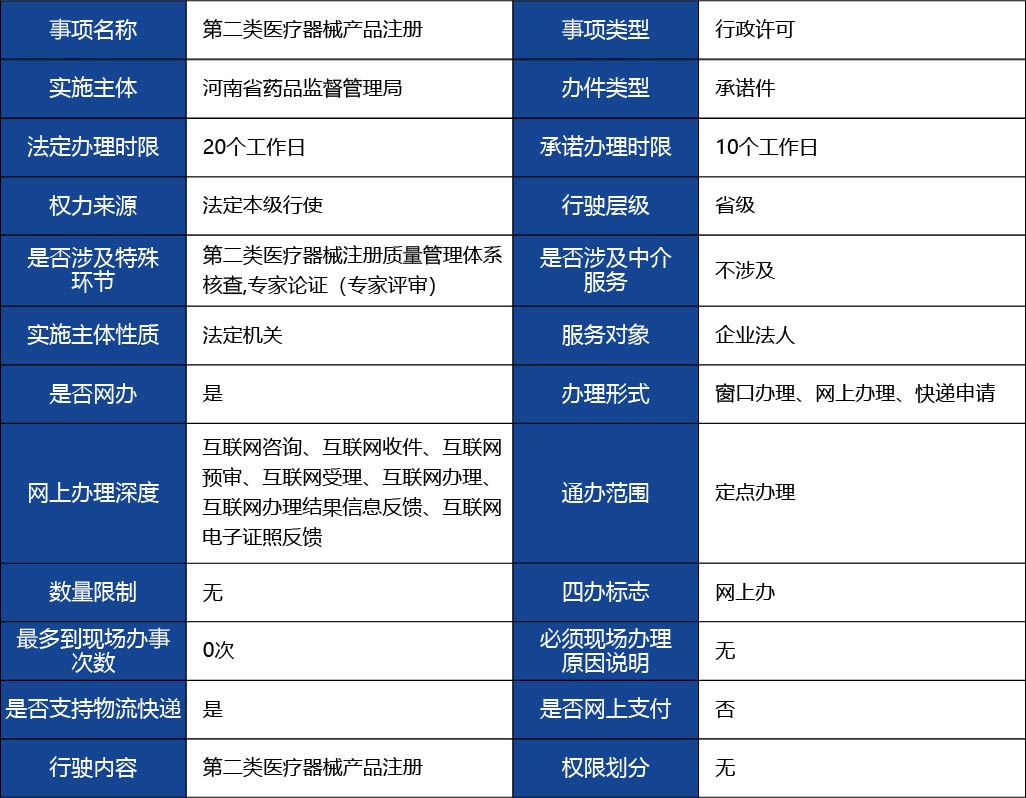
1.申報產品已確定為第二類醫療器械(不包含體外診斷試劑),注冊申請人為河南省省內企業;
2.按照有關規定取得企業營業執照或事業單位法人證書;
3.已具備擬注冊產品的生產能力;已按照《醫療器械生產質量管理規范》的要求建立醫療器械生產質量管理體系;
4.已編制完成擬申請產品的醫療器械產品技術要求,完成注冊檢測且結論為合格;
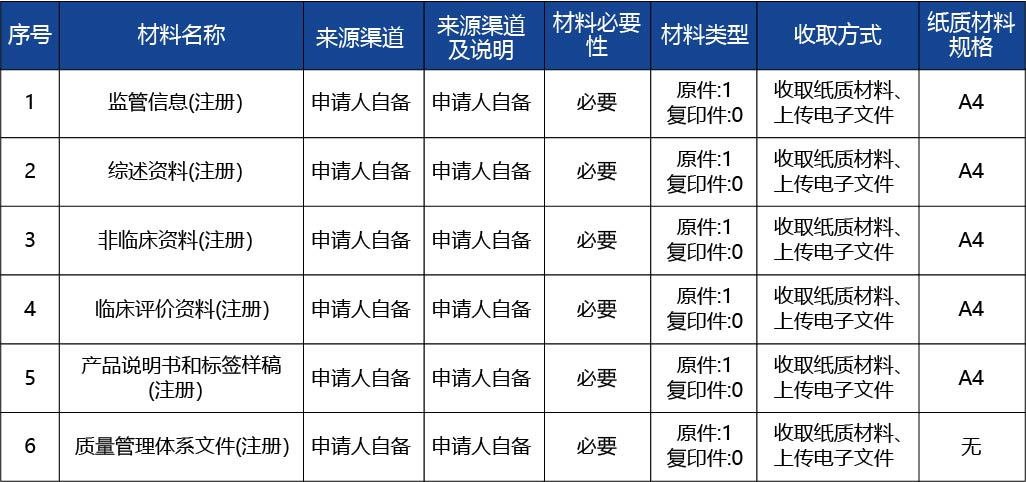
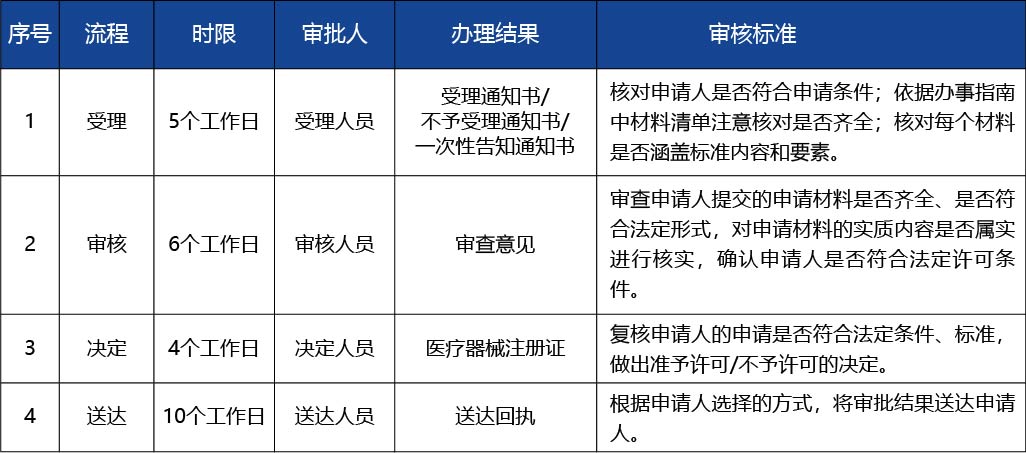
審批結果

1、《醫療器械監督管理條例》(中華人民共和國國務院令第739號)第十六條:“申請第二類醫療器械產品注冊,注冊申請人應當向所在地省、自治區、直轄市人民政府藥品監督管理部門提交注冊申請資料。……”。
2、《醫療器械注冊與備案管理辦法》(國家市場監督管理總局令第47號)第八條:“……第二類、第三類醫療器械實行注冊管理。……境內第二類醫療器械由省、自治區、直轄市藥品監督管理部門審查,批準后發給醫療器械注冊證。……”
不收費





